¿Por qué siempre tienes hambre? Los mecanismos fisiológicos detrás de la sensación de hambre
PUNTOS IMPORTANTES:
- La sensación de hambre constante es común y frustrante, igual que los atracones por ansiedad.
- Hormonas y neurotransmisores en el cerebro controlan el hambre, las ganas de comer y la saciedad.
- El ejercicio, la falta de sueño y el estrés regulan el hambre más de lo que crees.
- Comer suficientes calorías y alimentos ricos en fibra y con baja densidad energética es clave.
¿Alguna vez te has preguntado por qué siempre tienes hambre? La sensación de hambre constante es muy incómoda, especialmente cuando estás intentando perder grasa o seguir una dieta saludable.
Esta sensación es una respuesta normal del cuerpo cuando necesita combustible. Los mecanismos fisiológicos del hambre son complejos e implican una serie de hormonas y neurotransmisores en el cerebro que controlan el apetito y el metabolismo en respuesta a distintos estímulos homeostáticos (cualquier cambio interno o externo que desencadena una respuesta fisiológica en un organismo con el objetivo de mantener el equilibrio interno del cuerpo, lo que es esencial para la supervivencia) y desencadenantes socio-culturales.
En este artículo te explicaré los mecanismos fisiológicos detrás de la sensación de hambre y por qué puedes sentir hambre siempre.
El hambre y la ansiedad
Ya hemos tocado este tema en un post anterior, pero a modo de introducción, refresquemos la idea de que el hambre nos hace perder esa capacidad humana de auto-control, especialmente en cuanto a controlar la ingesta de alimentos ultraprocesados e hiper palatables se refiere.
Además, parece que la ingesta repetitiva de snacks de este tipo (véase el helado de turno o el dulcecito del café) modulan los sistemas de recompensa del cerebro y las preferencias de consumo (1), facilitando que cada vez el cuerpo “nos pida” alimentos más azucarados, grasos y calóricos.
Como aprenderás a continuación, sentirte saciado por medio de los alimentos adecuados y estar ocupado con actividades que te parezcan interesantes e importantes te ayudará a controlar los impulsos por comer y a mantener el apetito a raya.
Si no eres un friki de la fisiología, puedes bajar hasta "¿qué hago hoy de comer?"
Mecanismos fisiológicos del hambre: nuestro cerebro como director de orquesta
Simplificando hasta el extremo, podríamos clasificar en 2 tipos los motivos por los que comemos: motivaciones homeostáticas y motivaciones hedónicas. Las primeras se refieren a la necesidad fisiológica de mantenernos con energía y primar nuestra supervivencia. Estos procesos fisiológicos nos instan a escoger los alimentos con mayor densidad calórica, regulan nuestros deseos de luchar o mantener relaciones sexuales según la disponibilidad energética o nos dicen que comamos más de lo que necesitamos en ese momento por si llegase una hambruna inesperada.
Las motivaciones hedónicas, también están fuertemente reguladas por señales homeostáticas, pero tienen un gran componente socio-cultural y emocional. Por eso, aunque salir a comer con nuestros seres queridos puede ser un desencadenante para la sobre ingesta y el descontrol, ir en situación de déficit energético o de sueño aumentará exponencialmente las probabilidades de saltarnos desmesuradamente nuestra dieta.
LOS 3 SISTEMAS QUE CONTROLAN EL APETITO
El núcleo arqueado del hipotálamo… “en búsqueda de comida”
El primer sistema implica al núcleo arqueado del hipotálamo (ARC), una pequeña estructura cerebral que está posicionada para tener acceso a las hormonas y péptidos que pueden atravesar la barrera hematoencefálica, como son la famosa insulina, la leptina o la grelina.
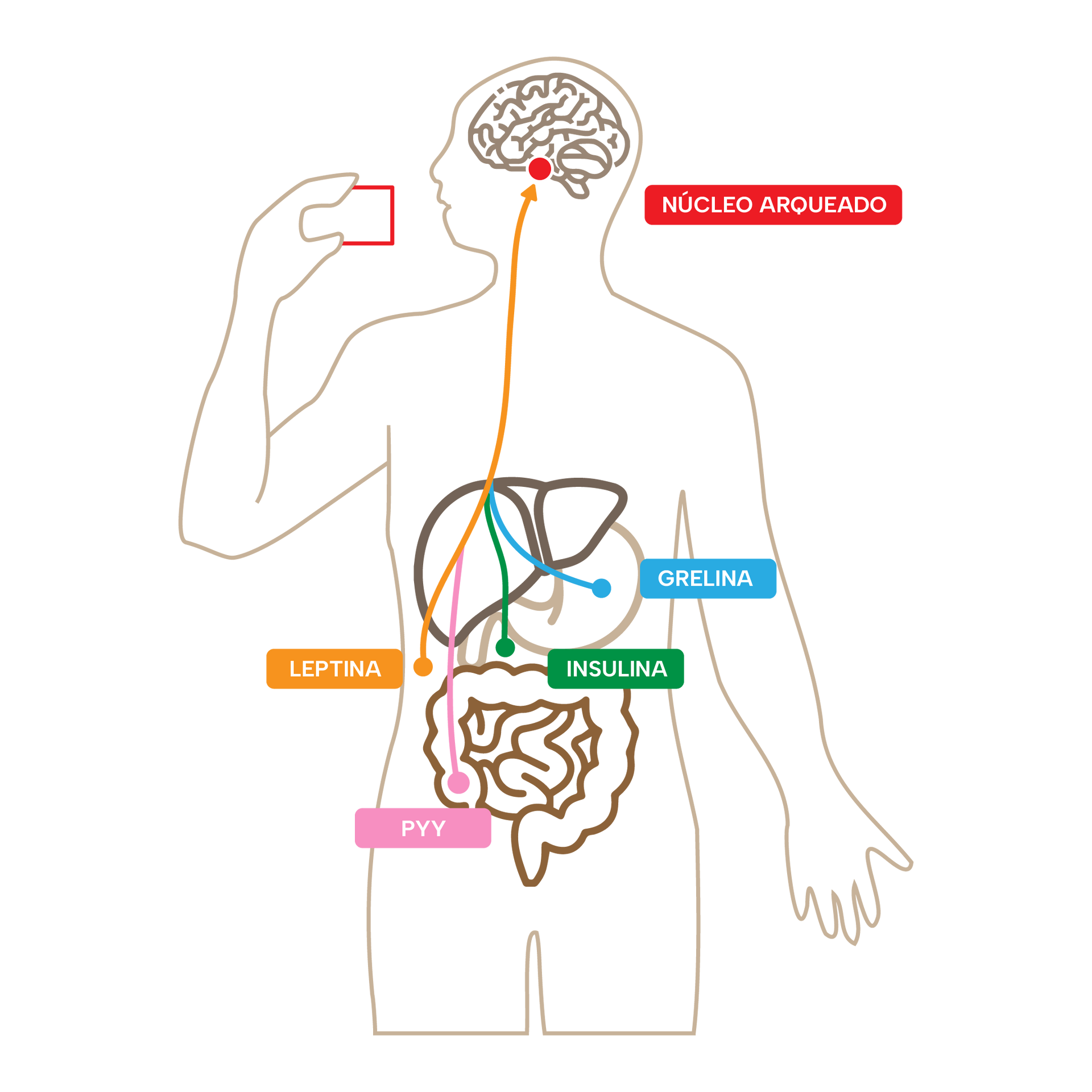
El ARC, por medio de las neuronas AGRP (neuronas que producen el péptido relacionado con el agouti) , vigila los niveles en sangre de estas hormonas. La insulina, por ejemplo, inhibe la producción de AGRP en el ARC por parte de sus neuronas especializadas. La grelina derivada del intestino, cuando está elevada, o la leptina derivada del tejido adiposo, cuando está baja, regulan al alza la producción de AGRP y a la baja la producción de POMC (pro-opiomelanocortina, otra proteína precursora que se procesa en el hipotálamo para producir varios neuropéptidos importantes). Así mismo, estas neuronas liberan un neurotransmisor llamado GABA (ácido gamma-aminobutírico) y el neuropéptido Y (NPY), que promueven la alimentación cuando se inyectan en el cerebro junto al anteriormente mencionado AGRP, que actúa como neuromodulador. Aunque parece muy mecanístico, la realidad es que no es siempre exactamente así, pero por esta vez es preferible continuar haciéndolo más sencillo.
En la constante búsqueda de homeostasis energética, la producción de POMC trabaja en una escala temporal más larga en cuanto a mantenimiento del peso y no tiene una influencia tan inmediata sobre el comportamiento como las neuronas AGRP.
AGRP
El AGRP es un regulador clave del apetito y del balance energético en el cuerpo. Ante señales de baja disponibilidad energética, los niveles de AGRP comienzan a elevarse, produciéndose un aumento del apetito y una reducción del gasto calórico en reposo, lo que puede llevar a un aumento de peso. El AgRP actúa en el cerebro interfiriendo con la señalización de la leptina, de la cual hablaremos más adelante.
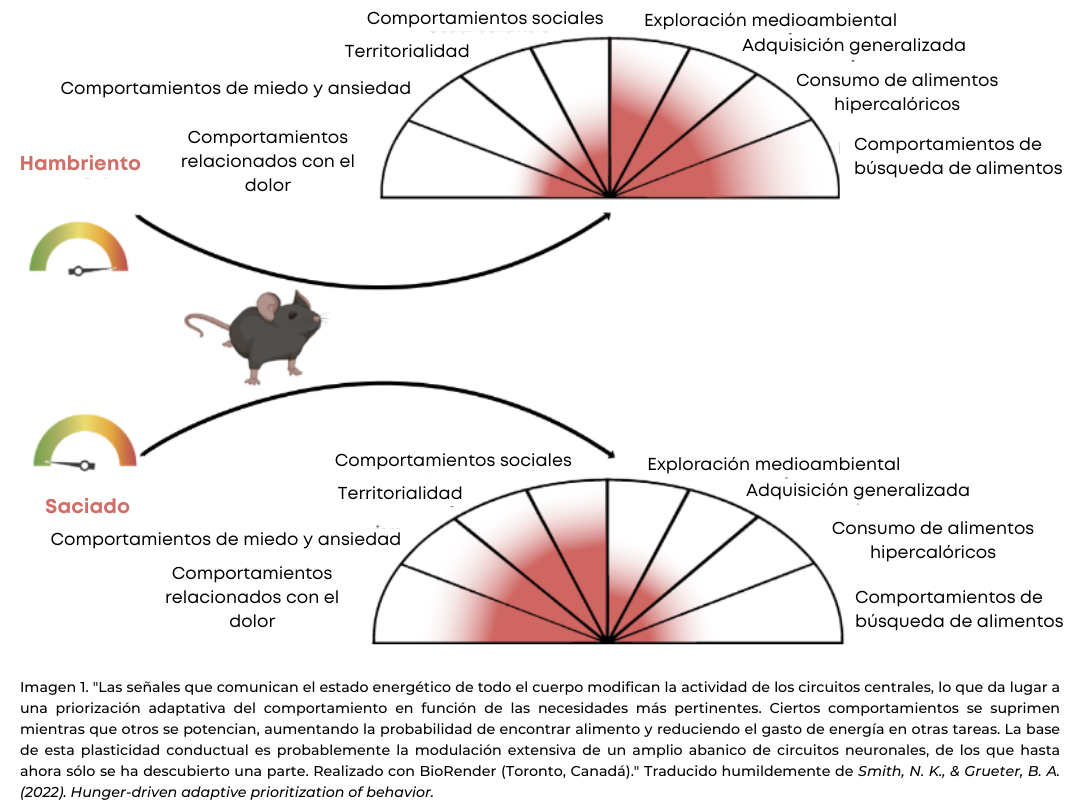
Además, cuando las neuronas especializadas AgRP están activas, ponen en marcha toda una cascada de respuestas fisiológicas que te mantienen activo y motivado para encontrar comida. Así pues, la activación de las neuronas AGRP son una especie de "acelerador de coche" de la alimentación; cuanto más se activen, mayores serán los impulsos para ir a por comida.
Curiosamente, parece ser que estas neuronas también te hacen sentir mal e infeliz para que busques comida. Por ejemplo, cuando sigues una dieta baja en calorías o llevas tiempo sin comer, la actividad de las neuronas AGRP provoca una sensación desagradable. Sin embargo, las sensaciones de dolor físico parecen disminuir (2), lo que tiene sentido desde un punto de vista evolutivo en el cual ir a buscar alimento es más importante que compadecerse dentro de la cueva. Por eso es tan difícil sentarse en el sofá y no hacer nada cuando se tiene hambre, y cuanto más desagradable sea esa sensación, mayor dificultad para controlarte. (otro motivo para no hacer dietas muy restrictivas, guiño guiño). En definitiva, las neuronas AGRP hacen que quieras levantarte y moverte, preferiblemente hacia la nevera o la despensa y en parte, por esto es mucho más fácil seguir una dieta cuando te mantienes activo y distraído con cosas que te motivan.
Si has leído atentamente, puede que te hayas dado cuenta de que en las sociedades modernas, cuando esa sensación de hambre nos invade, no es necesario un gasto calórico asociado a ir a buscar comida. No hay un proceso de caza, recolección o pesca. Ingerimos muchas más calorías que nuestros antepasados sin apenas tener la necesidad de invertir energía en el proceso.
POMC
La POMC es un precursor de varias moléculas bioactivas, incluyendo la alfa-melanocitoestimulante (α-MSH), que es un potente supresor del apetito y un modulador de la saciedad. La α-MSH actúa en el cerebro, en un grupo de neuronas que expresan POMC y que son conocidas como neuronas POMC. Estas neuronas son importantes reguladores del peso corporal y la homeostasis energética y secretan α-MSH en respuesta a la leptina, la cual informa al cerebro sobre la cantidad de energía almacenada en el cuerpo. Por lo tanto, la POMC y sus productos derivados, como la α-MSH, modulan la regulación del apetito y el peso corporal y participan en el balance energético del cuerpo.
Leptina
La leptina, una hormona segregada por el tejido adiposo (es decir, las células grasas), informa al núcleo arqueado (y a otras áreas cerebrales) sobre las reservas de energía en forma de grasa. Mucha grasa corporal significa mucha leptina circulante, mientras que muy pocas reservas de grasa significan niveles más bajos de leptina circulante. Como mencionaba anteriormente, esto no es tan mecanístico; en este caso sin ir más lejos puede darse resistencia a la leptina igual que a la insulina (3,4). Además, los niveles circulantes de leptina también están influenciados por otros factores y hormonas, pero para simplificar, se podría decir que los niveles altos de leptina señalan que las reservas de energía son altas, y disponer de suficientes reservas de energía en forma de grasa significa no tener que buscar más comida.
Los niveles altos de leptina reducen la actividad de las neuronas ARGP al tiempo que activan las neuronas POMC, haciendo que tengas menos hambre y menos motivación para buscar comida, a la vez que aumenta tu tasa metabólica. Esto, al igual que todos los anteriores, se trata de un mecanismo evolutivo para mantener el peso corporal relativamente estable. De igual forma, cuando se reduce la masa grasa por restricción calórica, niveles bajos de leptina activarán constantemente tus neuronas AGRP, haciendo que tengas hambre y ganas de comer a la vez que tu gasto energético se reduce.
Como curiosidad, los individuos que han sido obesos tienen “peor sensibilidad” y necesitan más leptina (masa grasa) para crear un estado de suficiencia en el sistema nervioso y que este no nos envíe continuamente a ir a por comida. Una vez alcanzado cierto umbral de leptina, un mayor aumento en las concentraciones circulantes de leptina tienen poco efecto fisiológico. Este umbral molecular-celular individual de leptina no disminuye con la pérdida de peso ni con el mantenimiento prolongado de un peso reducido (5); Por lo tanto, la respuesta metabólica/conductual a la reducción de leptina no disminuye.
Hipotálamo lateral (HL)...¡porque te lo mereces!
Al tener comida delante, la activación de las neuronas AGRP decae para dar pie a la activación del hipotálamo lateral (HL), otra región pequeña pero conservada evolutivamente en el centro del cerebro que está fuertemente conectada con los centros de recompensa del cerebro, como el área tegmental ventral, el cuerpo estriado ventral, la sustancia negra y el núcleo accumbens. De hecho, en base a estudios en murinos, parece que el LH obedece más a los propios deseos de encontrar placer y recompensa que a la necesidad de comida (6,7).

Al comer, los circuitos neuronales del LH se activan y envían señales a los centros de recompensa del cerebro de que algo bueno está ocurriendo. Por supuesto, cuanto más palatable (sabrosa y con textura agradable al paladar) sea la comida, mayor será la respuesta de recompensa, sobre todo si es rica en carbohidratos, grasa y sal. Curiosamente, los edulcorantes artificiales no activan de la misma manera estas regiones del cerebro; lo que nos hace entrever que este, ante todo, responde a las calorías y composición de los alimentos por encima de cualquier otra característica (8), dato extremadamente relevante en el manejo de la obesidad…y de la nutrición deportiva.
Sabemos que “auto-recompensarse” con estos alimentos hiper-palatables e hipercalóricos mejora el estado de ánimo, otra característica de la activación del hipotálamo lateral y el sistema de recompensa asociado, sobretodo en un contexto de hambre o dieta muy estricta (otro punto para la dieta flexible).
Cuando comemos alimentos que nos gustan, nuestro cerebro libera sustancias químicas como la dopamina, la serotonina, opioides o cannabinoides que provocan sensaciones positivas. Cuando estamos estresados o tristes, la comida suele ser una vía de escape relativamente accesible y barata para hacernos sentir mejor.
Sin embargo, si todo está bien (y aquí son más importantes los hábitos que algún día del mes suelto), nuestro cerebro también nos dice cuándo debemos dejar de comer. Recuerda dedicarte tiempo a ti y a tus emociones; evalúa la situación y ataca los verdaderos problemas. Como siempre escribo: si el problema no tiene nada que ver con el movimiento, seguramente la comida no sea la solución.
Núcleo parabraquial (PBN)...ya está bien por hoy
Empezamos a sentirnos saciados en respuesta al volumen de comida y las calorías ingeridas. Diversas señales comunican el estado actual de disponibilidad de energía (principalmente a través del nervio vago) al rombencéfalo. Estas señales incluyen la grelina, los péptidos intestinales (como el péptido tirosina-PYY, la colecistoquinina-CCK y el péptido similar al glucagón-1-GLP-1), la insulina, la amilina (una enzima que ayuda a digerir las proteínas) y la leptina. Todas estas señales llegan a parar a un circuito neuronal encargado de hacernos sentir saciados, constituido por las neuronas del péptido relacionado con el gen de la calcitonina (CGRP) del núcleo parabraquial (PBN), que suprimen la ingesta de alimentos cuando se activan, pero no la aumentan cuando se inhiben.

Cuando una persona come, las neuronas PBN-CGRP se activan en respuesta a señales sensoriales, como el sabor y la textura de los alimentos, así como señales metabólicas que indican el estado de energía del cuerpo. Cuando estas neuronas se activan fuertemente, proporcionan una señal de saciedad que tiene una valencia negativa, lo que significa que disminuyen la sensación de hambre y promueven la sensación de saciedad.
Esta señal de saciedad es importante para regular la ingesta de alimentos y mantener un equilibrio energético adecuado en el cuerpo. En las personas con obesidad o trastornos alimentarios, se ha observado que la señal de saciedad proporcionada por las neuronas PBN-CGRP puede ser disfuncional, lo que puede contribuir a la ingesta excesiva de alimentos y el aumento de peso.
Las neuronas PBN-CGRP también están activas cuando se tienen náuseas o se está enfermo, razón por la que en estas situaciones no queremos comer absolutamente nada, por mucho que suela apetecernos (en mi caso, si no tengo ganas de tortilla de patatas sé que estoy realmente malo). Un concepto relacionado es la aversión al sabor; si comes algo y te pones enfermo, estas neuronas "recordarán" ese sabor y lo asociarán con la sensación de malestar.
¿Qué hago hoy de comer ?
Una vez repasada la teoría, vayamos a la práctica. Como hemos visto, mantener a nuestro cerebro ocupado en tareas que nos estimulen positivamente y preferiblemente en movimiento ya es una estrategia poderosísima para controlar el hambre y las ganas de comer.
La comida siempre será una vía de escape para obtener placer, por lo que un hobbie placentero y saludable nos ayudará a darle a los alimentos un enfoque más nutricional, en el sentido literal de la palabra.
Evidentemente, también hay muchos factores dietéticos que influyen a la hora de manipular las señales de saciedad, como son la cantidad de fibra ingerida, las calorías y reparto de macro y micronutrientes de la comida, el contenido de agua en el estómago, la cantidad relativa de grasa corporal o incluso la temperatura a la que se encuentra el alimento.
A grosso modo, los alimentos altos en fibra, agua y micronutrientes poco procesados tardarán poco en mantenerte saciado. Por eso es tan complicado que se te vaya de las manos comiendo plátanos…pero es muy fácil que pase si los plátanos están en forma de helado con chispitas de chocolate y nata por encima.
La influencia de la microbiota
La microbiota intestinal influye en la comunicación entre el tracto gastrointestinal y el cerebro de forma bidireccional; esta comunicación se conoce como eje intestino-cerebro. La investigación in vitro y los estudios en animales indican que existe una relación entre la microbiota intestinal y la regulación de la saciedad y la ingesta de energía mediante diferentes vías directas e indirectas.
Aunque todavía no está claro cómo los metabolitos microbianos intestinales contribuyen a estos procesos en humanos, cada vez tenemos evidencia más sólida de los beneficios de los ácidos grasos de cadena corta (short-chain fatty acids, SCFA) en la regulación de la inflamación, el sistema inmune y la salud general.
La suplementación con prebióticos (como el éster de inulina-propionato) y/o la adecuada ingesta de fibra dietética por medio de frutas, legumbres, verduras, frutos secos y cereales (esto es lo recomendado) son las causantes de la producción de estos SCFA por parte de la microbiota intestinal.
Esta fibra es el componente dietético más estudiado y vincula los AGCC de la microbiota intestinal con la regulación de la saciedad. La ingesta de fibra alimentaria reduce la sensación de apetito y la ingesta de energía a corto y largo plazo, y altera la liberación de péptidos intestinales como GLP-1 y PYY. Los AGCC también se han relacionado con una disminución en la ingesta de energía. Puede ser que los efectos de la fibra dietética en la microbiota intestinal sean los responsables de estos resultados, o también pueden deberse a una correlación entre la ingesta de fibra y el volumen de alimentos con baja densidad energética (recordemos que las señales de saciedad también están influenciadas por el volumen de comida ingerida).
Sea como fuere, los estudios en humanos que exploran la relación entre la ingesta de fibra dietética, la microbiota intestinal y los efectos relacionados con la saciedad siguen siendo limitados, por lo que de momento sigamos comiendo suficiente fibra mientras la ciencia dilucida todos y cada uno de sus beneficios.
Ejercicio físico y hambre
El ejercicio tiende a suprimir el apetito de forma aguda y transitoria, siempre que el nivel de intensidad sea lo suficientemente alto (9). Y lo que es más importante, la actividad física regular (que incluye, aunque no se limita, al ejercicio estructurado) influye en la regulación del hambre y la saciedad, de forma que el apetito y la ingesta de energía están más estrechamente relacionados con el gasto energético. Como resultado, el impacto de un cambio en el nivel de actividad sobre el apetito depende del contexto; se puede notar una reducción no intencionada de la ingesta energética cuando se pasa de muy sedentario a algo activo, pero un aumento no intencionado de la ingesta energética cuando se pasa de activo a muy activo. Además, parece que el efecto del ejercicio sobre el apetito está sujeto a un grado no despreciable de variación interindividual, pero los investigadores no han identificado de forma concluyente las características exactas y los factores contextuales que impulsan esta aparente variación.
Hambre, estrés y sueño
El esfuerzo por reducir calorías y perder peso puede verse afectado por la restricción del sueño. Un mal descanso afecta a la tolerancia a la glucosa y la sensibilidad a la insulina, aumenta los niveles de cortisol y grelina, disminuye la leptina y aumenta el hambre y las ganas de comer; si no hay energía ni placer por descansar, habrá que compensar comiendo . Además, la restricción del sueño cambia las preferencias alimentarias hacia opciones más densas en calorías y hedónicamente recompensantes, obligándonos a tirar de disciplina para cumplir la dieta. Esta disciplina y autocontrol también se ven disminuidas con la falta de descanso, por cierto.
El estrés y el sueño suelen conllevar problemas similares. El estrés puede inducir la pérdida del sueño, la privación del sueño puede aumentar el estrés subjetivo y la ansiedad, y tanto el estrés subjetivo como la privación del sueño pueden influir en el metabolismo.
Los efectos del estrés son principalmente dictados por el cortisol, con efectos secundarios en la testosterona, la leptina, la grelina, el apetito y un cambio hacia preferencias alimentarias más hedónicas y calóricamente densas, en este caso por una necesidad creciente de auto-recompensarnos por soportar tanto estrés. Como ya mencionamos en el artículo anterior, nada ejemplifica mejor esto que el atracón de los viernes el cual decimos “merecernos” por una semana entera de trabajo duro y estresante.
Desgraciadamente, el estrés puede ser difícil de evitar mientras queremos perder grasa corporal (o en la vida en general), por lo que suele ser un problema recurrente en consulta. Además de las técnicas básicas de manejo del estrés, los enfoques más directos para mitigar el exceso de estrés durante la pérdida de peso incluyen priorizar hábitos efectivos de sueño, flexibilidad en los objetivos de pérdida de peso y evitar estrategias de dieta y ejercicio que causen rechazo constante. Evidentemente, quien más puede ayudarte a manejar el estrés es un profesional cualificado.
Al final…la vida sigue igual
Además de los no pocos factores y mecanismos involucrados en el hambre, las ganas de comer y la saciedad, cada día se van abriendo más melones científicos que se suman a la casi infinita ecuación de la salud humana.
La exposición al sol y a la naturaleza, influencias socio-culturales, la contaminación o la genética son algunas de estas variables a tener en cuenta. Sin embargo, conforme la ciencia y el ser humano avanzan, también resultan evidentes los verdaderos pilares de la salud humana, de los cuales ya hemos hablado en este blog: buen descanso y salud mental, alta actividad y ejercicio físicos y una correcta alimentación que incluya sobre todo vegetales y alimentos poco procesados.
En la era de la información y la inteligencia artificial, no te dejes engañar por charlatanes, magufos y demás vendehumos que dicen tener la solución a todos los problemas y que no estás sano y feliz porque no quieres. Haz sentadillas hasta que te tiemblen las piernas, duerme como si no hubiera un mañana, cómete una ensalada de garbanzos y no te fíes de lo que digan en televisión. Igual no es el mejor consejo, pero es el mío.
REFERENCIAS Y BIBLIOGRAFÍA
Gran parte de este artículo adapta humildemente el contenido del paper y el posterior artículo en Mass Research Review de Anne-Kathrin Eiselt, December 2019. How the Brain Controls Eating Behavior, Mass Research Review, Volume 3, Issue 12; posiblemente el mejor artículo sobre la neurofisiología del hambre y el apetito.
(1)Edwin Thanarajah, S., DiFeliceantonio, A. G., Albus, K., Kuzmanovic, B., Rigoux, L., Iglesias, S., Hanßen, R., Schlamann, M., Cornely, O. A., Brüning, J. C., Tittgemeyer, M., & Small, D. M. (2023). Habitual daily intake of a sweet and fatty snack modulates reward processing in humans. Cell metabolism, 35(4), 571–584.e6. https://doi.org/10.1016/j.cmet.2023.02.015
(2)Smith, N. K., & Grueter, B. A. (2022). Hunger-driven adaptive prioritization of behavior. The FEBS journal, 289(4), 922–936. https://doi.org/10.1111/febs.15791
(3) Li M. D. (2011). Leptin and beyond: an odyssey to the central control of body weight. The Yale journal of biology and medicine, 84(1), 1–7.
(4) Myers, M. G., Jr, Leibel, R. L., Seeley, R. J., & Schwartz, M. W. (2010). Obesity and leptin resistance: distinguishing cause from effect. Trends in endocrinology and metabolism: TEM, 21(11), 643–651. https://doi.org/10.1016/j.tem.2010.08.002
(5)Rosenbaum, M., Kissileff, H. R., Mayer, L. E., Hirsch, J., & Leibel, R. L. (2010). Energy intake in weight-reduced humans. Brain research, 1350, 95–102. https://doi.org/10.1016/j.brainres.2010.05.062
(6)Kenny P. J. (2011). Reward mechanisms in obesity: new insights and future directions. Neuron, 69(4), 664–679. https://doi.org/10.1016/j.neuron.2011.02.016
(7)Rolls E. T. (2007). Sensory processing in the brain related to the control of food intake. The Proceedings of the Nutrition Society, 66(1), 96–112. https://doi.org/10.1017/S0029665107005332
(8) Tellez, L. A., Ren, X., Han, W., Medina, S., Ferreira, J. G., Yeckel, C. W., & de Araujo, I. E. (2013). Glucose utilization rates regulate intake levels of artificial sweeteners. The Journal of physiology, 591(22), 5727–5744. https://doi.org/10.1113/jphysiol.2013.263103
(9) Tobin, S. Y., Cornier, M. A., White, M. H., Hild, A. K., Simonsen, S. E., Melanson, E. L., & Halliday, T. M. (2021). The effects of acute exercise on appetite and energy intake in men and women. Physiology & behavior, 241, 113562. https://doi.org/10.1016/j.physbeh.2021.113562
Singh, R. K., Chang, H. W., Yan, D., Lee, K. M., Ucmak, D., Wong, K., Abrouk, M., Farahnik, B., Nakamura, M., Zhu, T. H., Bhutani, T., & Liao, W. (2017). Influence of diet on the gut microbiome and implications for human health. Journal of translational medicine, 15(1), 73. https://doi.org/10.1186/s12967-017-1175-y
Sternson, S. M., & Eiselt, A. K. (2017). Three Pillars for the Neural Control of Appetite. Annual review of physiology, 79, 401–423. https://doi.org/10.1146/annurev-physiol-021115-104948
Parikh, S., Parikh, R., Michael, K., Bikovski, L., Barnabas, G., Mardamshina, M., Hemi, R., Manich, P., Goldstein, N., Malcov-Brog, H., Ben-Dov, T., Glaich, O., Liber, D., Bornstein, Y., Goltseker, K., Ben-Bezalel, R., Pavlovsky, M., Golan, T., Spitzer, L., Matz, H., … Levy, C. (2022). Food-seeking behavior is triggered by skin ultraviolet exposure in males. Nature metabolism, 4(7), 883–900. https://doi.org/10.1038/s42255-022-00587-9
Mayer, E. A., Nance, K., & Chen, S. (2022). The Gut-Brain Axis. Annual review of medicine, 73, 439–453. https://doi.org/10.1146/annurev-med-042320-014032
LeDuc, C. A., Skowronski, A. A., & Rosenbaum, M. (2021). The Role of Leptin in the Development of Energy Homeostatic Systems and the Maintenance of Body Weight. Frontiers in physiology, 12, 789519. https://doi.org/10.3389/fphys.2021.789519
Kelesidis, T., Kelesidis, I., Chou, S., & Mantzoros, C. S. (2010). Narrative review: the role of leptin in human physiology: emerging clinical applications. Annals of internal medicine, 152(2), 93–100. https://doi.org/10.7326/0003-4819-152-2-201001190-00008
Della Guardia, L., & Codella, R. (2023). Exercise Restores Hypothalamic Health in Obesity by Reshaping the Inflammatory Network. Antioxidants (Basel, Switzerland), 12(2), 297. https://doi.org/10.3390/antiox12020297
Martínez-Gómez, M. G., & Roberts, B. M. (2022). Metabolic Adaptations to Weight Loss: A Brief Review. Journal of strength and conditioning research, 36(10), 2970–2981. https://doi.org/10.1519/JSC.0000000000003991
COMPARTE